Todo lo que necesitas para enseñar la estructura atómica y su periodicidad en la etapa post-16 | Continuando el desarrollo profesional
Aprender sobre la estructura atómica ayuda a los estudiantes a comprender cómo y por qué los elementos interactúan con otros (o no) y sus ubicaciones específicas en la tabla periódica.
La tabla periódica permite a los químicos predecir con éxito las propiedades de elementos no descubiertos previamente y continuar sintetizándolos, un concepto importante para un mundo sostenible basado en materiales y tecnología inteligentes.
La mayoría de los estudiantes -y algunos profesores- subestiman la riqueza de conocimientos contenidos en la tabla periódica. Una de mis mejores herramientas didácticas fue colocar una tabla periódica a gran escala en la pared del aula con símbolos químicos, masas y números atómicos dibujados a mano en páginas tamaño A4. Era perfecto para enseñar masa molecular, moles, disposición electrónica, valencia y tendencias periódicas.
La estructura atómica y el ciclo son las materias que proporcionan la base para cualquier especificación de Química de Nivel 3, como lo muestra la asignación del 28% de las calificaciones en el trabajo de Química de Nivel AS de 2022.
Lo que los estudiantes necesitan saber
Los estudiantes deberían poder determinar la cantidad de protones, electrones y neutrones de cualquier átomo, isótopos e iones de cualquier elemento de la tabla periódica. Proporcione aquí atracción nuclear, radios atómicos e iónicos, direcciones de reacción y radios. Enfatizando el papel de las atracciones electrostáticas dentro del átomo para mantener unidas las partículas subatómicas.
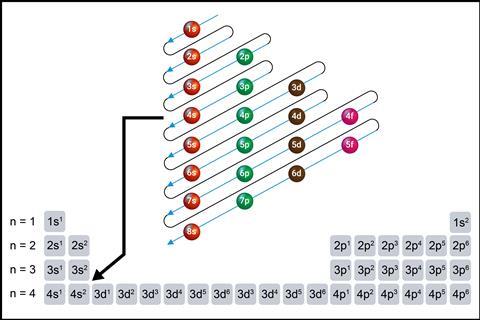
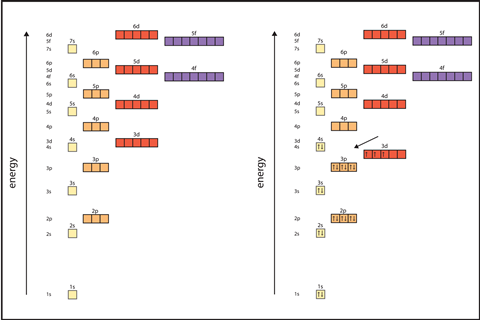
Es esencial que los estudiantes comprendan cómo se organizan los electrones en capas, subcapas y orbitales, y el orden en que se llenan los orbitales es esencial. Los efectos del espín de los electrones y la determinación de las disposiciones electrónicas de los metales de transición y qué disposiciones se consideran más estables son ideas fundamentales. Lógicamente, esto conduce a tendencias en las energías de ionización, las afinidades electrónicas y los puntos de fusión y ebullición.
Conceptos erróneos comunes
- Los átomos necesitan tener capas externas completas de electrones para ser estables.
- Los electrones son estacionarios.
- La atracción nuclear es unidireccional (del núcleo a los electrones).
- La cantidad de electrones que un átomo pierde o gana determina la cantidad de enlaces iónicos que puede formar. Por ejemplo, el sodio puede formar un enlace iónico único con el cloro.
- El núcleo atómico es el centro de control del átomo.
- Los protones del núcleo atraen un electrón cada uno.
- Los electrones repelen el núcleo.
- Definiciones de tendencias cíclicas y tendencias entre períodos.
Ideas para tu aula
Antes de introducir el tema de la estructura atómica, piense en trabajar hacia atrás. Mida 64 g de limaduras de cobre en una taza y pregunte:
- ¿Por qué elegiste 64 gramos?
- ¿Cuántos átomos hay en el vaso (inserte la constante de Avogadro)?
- ¿Puedes ahora contar el número de protones, neutrones y electrones en el vaso?
Pida a la clase que dibuje uno de los átomos de cobre para descubrir y eliminar cualquier idea errónea utilizando modelos atómicos y una analogía del sistema solar.
Antes de introducir subcapas y orbitales, evalúe los conocimientos previos con pruebas de diagnóstico para determinar un punto de partida. Las subcapas, los orbitales atómicos y los niveles de energía pueden ser un gran paso adelante desde el Nivel 2 para algunos estudiantes. Haga hincapié en que los electrones están en constante movimiento, con distintos grados de energía, y que un orbital es simplemente una región que representa la posición que más ocupa un electrón cuando está en movimiento. Este vídeo es de Modelos de Grzezinski de caída libre de elementos químicos. Ayudará a los alumnos a visualizar este movimiento.
Antes de introducir subcapas y orbitales, evalúe los conocimientos previos con pruebas de diagnóstico para determinar un punto de partida. Las subcapas, los orbitales atómicos y los niveles de energía pueden ser un gran paso adelante desde el Nivel 2 para algunos estudiantes. Haga hincapié en que los electrones están en constante movimiento, con distintos grados de energía, y que un orbital es simplemente una región que representa la posición que más ocupa un electrón cuando está en movimiento. Este vídeo es de los modelos de Grzezinski para la caída libre de elementos químicos (bit.ly/40pDHYk) Ayudará a los alumnos a visualizar este movimiento.
Descarga esto
Infografías y recursos para configuraciones electrónicas, para edades de 16 a 18 años.
Ayude a los estudiantes mayores de 16 años a comprender los orbitales y las capas pidiéndoles que corrijan y mejoren las configuraciones electrónicas incorrectas.
Descargue el póster, la hoja informativa y la actividad de evaluación entre pares del sitio web. educacion en quimica Sitio web: rsc.li/46SyURH
Escribir Configuraciones electrónicas Correctamente, los estudiantes deben ser conscientes de los diferentes niveles de energía de las capas que rodean el núcleo, el número de electrones en cada subnivel y orbital, y el orden en que se llenan.
Cuando necesites pasar a la superposición de los orbitales 4s y 3d, usa la tabla periódica para mostrar a los estudiantes cómo se llenan los electrones 4s antes de que los orbitales 3d estén vacíos. Recuérdeles que los orbitales 3d que contienen electrones tienen menor energía que los orbitales 4s y vienen antes que los orbitales 4s en configuraciones.
Cuando enseño la tendencia periódica en la energía de ionización, me gusta dar una tabla periódica en blanco y pedirle a la clase que escriba la configuración electrónica de la capa externa de los elementos del Período 3. Una vez terminado, proporciono los valores de los elementos del Período 3 y pida a los estudiantes que comparen la gráfica con la disposición de los electrones y sugieran razones para las diferentes energías.
Podría realizar una actividad similar para los puntos de fusión y ebullición: pida a los estudiantes que etiqueten los elementos de la tabla en blanco como metales o no metales, y como sólidos, líquidos o gases. También recomiendo estas ideas de modelado.
Podría realizar una actividad similar para los puntos de fusión y ebullición: pida a los estudiantes que etiqueten los elementos de la tabla en blanco como metales o no metales, y como sólidos, líquidos o gases. También recomiendo estas ideas de modelado: rsc.li/3Qz5AJc.
Más recursos
- Ayude a los estudiantes posteriores a 16 años a consolidar sus ideas sobre los átomos y la estructura atómica trabajando en parejas para identificar conceptos clave.
- Pruebe a sus alumnos sobre las tendencias de la tabla periódica, como puntos de fusión, energías de ionización y radios atómicos.
- Evalúe la comprensión de los estudiantes sobre el aprendizaje previo revisando el tema de la estructura atómica.
- Muestre este cartel en su salón de clases antes de asignar a estudiantes de entre 14 y 16 años que dibujen diagramas de configuración electrónica siguiendo los pasos fáciles de seguir del recurso.
- Haga un trabajo de seguimiento con sus alumnos sobre las tendencias de interacción en los Grupos 1 y 7.
Comprobar comprensión
La evaluación del aprendizaje puede ser más efectiva cuando los estudiantesHaga un cambio en su memoria a largo plazo”.. Por lo tanto, las actividades de evaluación deben ayudar a los estudiantes a acceder a conocimientos previos, motivarlos a estudiar, ayudar a identificar lagunas en el conocimiento y exponer y cuestionar conceptos erróneos. También se ha demostrado que el aprendizaje espaciado es eficaz, por lo que es necesario evaluar periódicamente los conocimientos para mejorar la memoria a largo plazo de los estudiantes. La hoja de trabajo inicial sobre la estructura atómica y el recurso sobre conceptos erróneos químicos están diseñados para hacer precisamente eso, y este capítulo de mapa de revisión del paquete de conceptos erróneos es ideal para evaluar el conocimiento de la tabla periódica.
La evaluación del aprendizaje puede ser más eficaz cuando los estudiantes “marcan una diferencia en su memoria a largo plazo” (bit.ly/3smInSg). Por lo tanto, las actividades de evaluación deben ayudar a los estudiantes a acceder a conocimientos previos, motivarlos a estudiar, ayudar a identificar lagunas en el conocimiento y exponer y cuestionar conceptos erróneos. También se ha demostrado que el aprendizaje espaciado es eficaz, por lo que los conocimientos se evalúan periódicamente para mejorar la memoria a largo plazo de los estudiantes. Utilice la Hoja de trabajo inicial sobre la estructura atómica (rsc.li/4730Sue) y los recursos sobre Conceptos erróneos químicos (rsc.li/472tl3a) para evaluar eficazmente el conocimiento.
Llévate puntos a casa
- La estructura atómica y periódica proporciona una base sólida para cualquier clase de Química de nivel 3.
- Apoyar el aprendizaje, incorporando modelos comparativos y seminales, y utilizando actividades de evaluación estratégica para desarrollar la memoria a largo plazo.
- Aproveche recursos gratuitos y de alta calidad para aclarar conceptos erróneos y practicar la identificación de partículas subatómicas, la escritura de configuraciones electrónicas y la comprensión de tendencias periódicas.
Johanne Brolly es ex docente y coordinadora de educación en Irlanda para el RSC.