SUO 2023: Agonista versus antagonista del receptor de andrógenos: morbilidad cardíaca
(UroToday.com) Reunión anual de la Sociedad de Oncología Urológica (SUO) 2023 celebrada en Washington, D.C., el 28 de noviembrey y el 1 de diciembrecallede 2023 acogió un curso de formación sobre el cáncer de próstata. La Dra. Alicia Morgans analizó la morbilidad cardíaca asociada con los agonistas del receptor de andrógenos (AR), en comparación con los antagonistas del receptor de andrógenos.
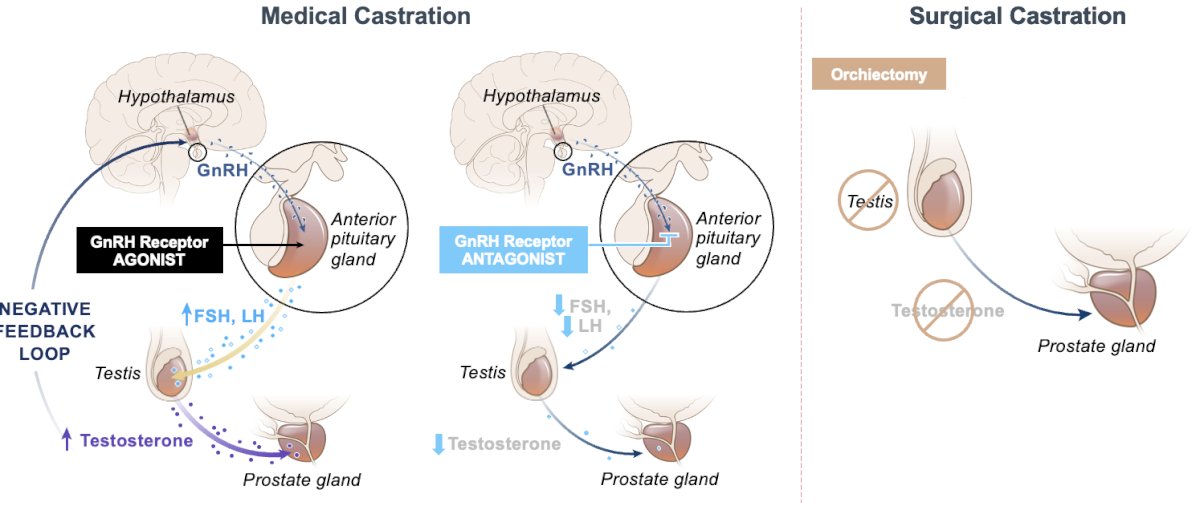
Hay dos categorías amplias de terapia de privación de andrógenos (ADT) para suprimir los niveles de testosterona:
- Castración quirúrgica: orquiectomía bilateral
- Castración médica, utilizando cualquiera de:
- Agonistas del receptor de la hormona liberadora de gonadotropina (GnRH).
- Los agonistas de la GnRH compiten con la GnRH producida en el hipotálamo y se unen a los receptores de la glándula pituitaria.
- En última instancia, esto conduce a una regulación negativa de la producción de LH y testosterona.
- Suelen estar asociados con un brote inicial que suele durar aproximadamente una semana.
- Antagonistas del receptor de GnRH
- Agonistas del receptor de la hormona liberadora de gonadotropina (GnRH).
Es importante recordar que la terapia hormonal para el cáncer de próstata reduce los niveles de testosterona y estrógeno, lo que tiene muchas consecuencias fisiológicas.
¿En qué se diferencian los agonistas y antagonistas de GnRH? Como se resume en la tabla siguiente, los antagonistas de GnRH se asocian con un tiempo mucho más corto hasta la castración (96 horas frente a 3 a 4 semanas), no inducen un aumento de testosterona y pueden tener tasas de fracaso del PSA más bajas. Esto tiene el costo de una mayor frecuencia de reacciones locales en el lugar de la inyección (40% frente a 1%) y la necesidad de inyecciones mensuales o píldoras orales diarias, en comparación con inyecciones intramusculares/subcutáneas cada tres meses con agonistas de GnRH.
Si bien todos los agonistas de GnRH son igualmente eficaces para controlar el cáncer, los antagonistas de GnRH pueden ser útiles en pacientes que requieren una reducción rápida de los niveles de testosterona (p. ej., pacientes con síntomas graves o en situaciones de emergencia inminente), médula espinal con hemiplejía inminente, dolor óseo intenso o obstrucción de la salida de la vejiga).
Si bien todavía existe cierta controversia sobre si los antagonistas de GnRH tienen un perfil de seguridad cardiovascular más favorable en comparación con los agonistas de GnRH, lo que está claro es que todos los ADT impactan negativamente en los factores de riesgo cardiovascular. La ADT aumenta los niveles de colesterol total, los niveles de triglicéridos y el tejido adiposo abdominal y altera el metabolismo de la glucosa.1 Las complicaciones médicas en los hombres ocurren debido a niveles bajos de testosterona y niveles bajos de estradiol. Mucha gente cree que la ADT causa la “menopausia masculina” debido a los sofocos y cambios en el estado de ánimo/libido asociados. Sin embargo, está claro que las complicaciones de la ADT pueden afectar significativamente las tasas de morbilidad y mortalidad en esta población.
Los mecanismos potenciales para el aumento del riesgo cardiovascular asociado con la ADT pueden variar desde agonistas hasta antagonistas, y se proponen los siguientes mecanismos principales:
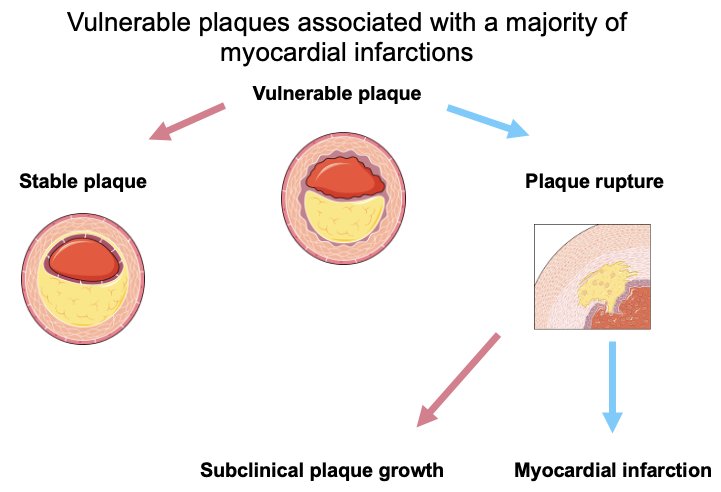
- Inflamación local por activación de células T inducida por agonistas de GnRH que conduce a la desestabilización y ruptura de la placa.
- Efectos proinflamatorios de la hormona folículo estimulante (FSH) y alteraciones mediadas por FSH en la adipogénesis y la liberación de adipocinas, que conducen a cambios cardiometabólicos
- Cardioprotección proporcionada por testosterona intermitente con ADT (ambas formas)
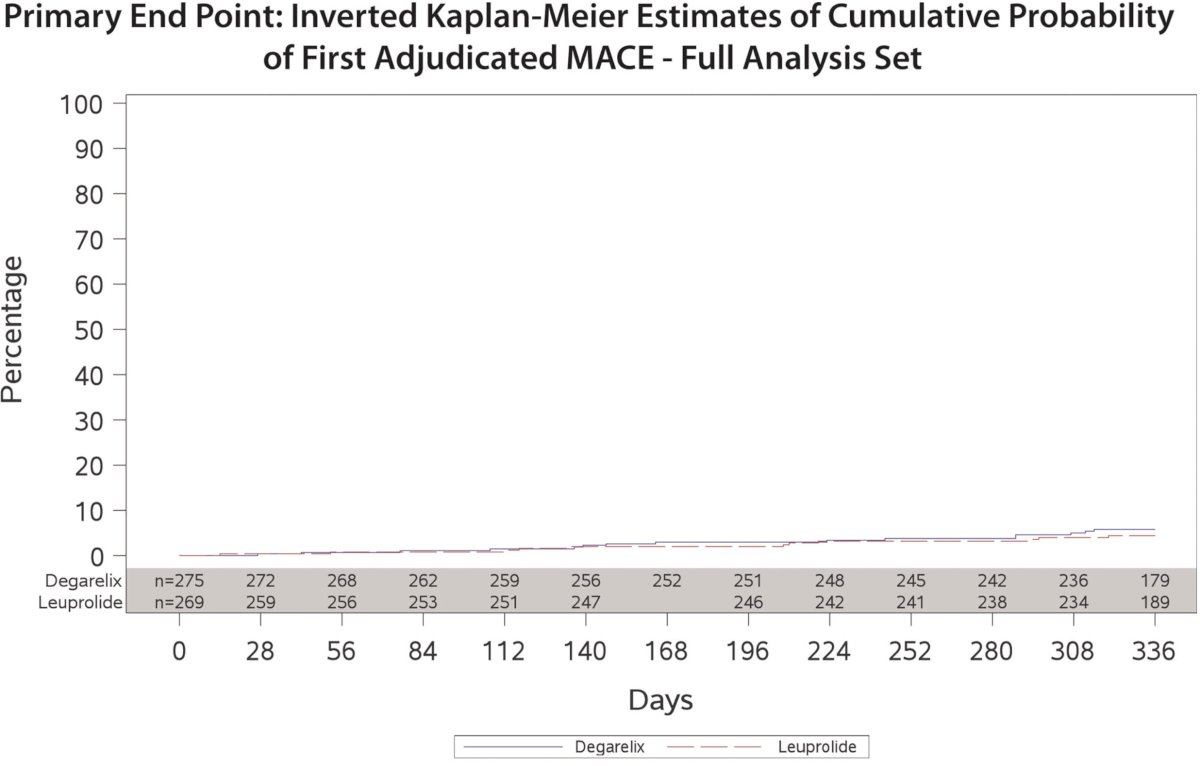
En 2014, Albertsen et al. demostró que degarelix (un antagonista de GnRH) se asoció con un menor riesgo de enfermedad cardiovascular, en comparación con los agonistas de GnRH, en un grupo de pacientes con antecedentes de enfermedad cardiovascular (~30%). Como se muestra en la curva de Kaplan-Meier a continuación, los pacientes que recibieron degarelix tuvieron una tasa significativamente menor de eventos cardiovasculares graves o muerte (HR: 0,44; IC del 95 %: 0,26 – 0,74).2
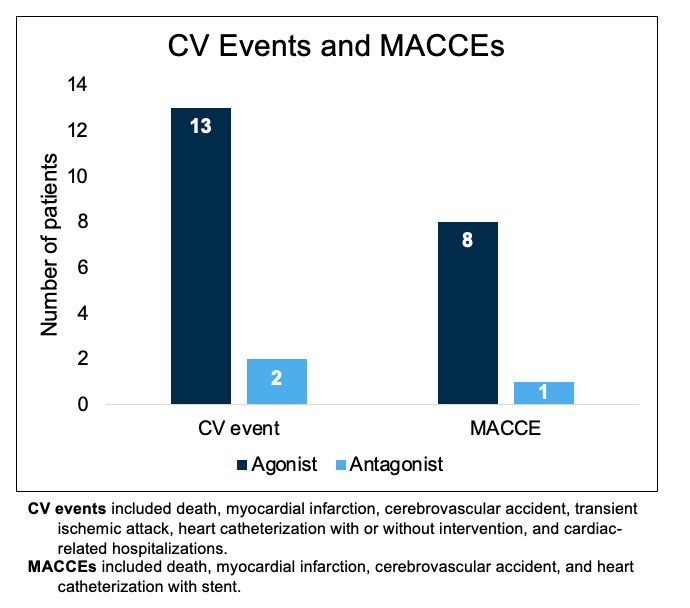
Estos hallazgos fueron confirmados de manera similar por Margill et al. quienes demostraron en un ensayo abierto de fase II que los antagonistas de GnRH se asociaban con un riesgo reducido de eventos cardiovasculares o eventos cardiovasculares y cerebrovasculares mayores.3
Una revisión sistemática y un metanálisis posteriores mostraron que hubo una reducción significativa tanto en los eventos cardiovasculares como en la mortalidad cardiovascular con los antagonistas de GRH, en comparación con los agonistas de GnRH.4
En 2020, se publicó en Nueva revista inglesa de medicina. Este fue un estudio multinacional, de fase III, aleatorizado, abierto y de grupos paralelos para evaluar la seguridad y eficacia de Relugolix en hombres con cáncer de próstata avanzado. El criterio de valoración principal fue la castración sostenida a las 48 semanas, definida como <50 ng/dl.
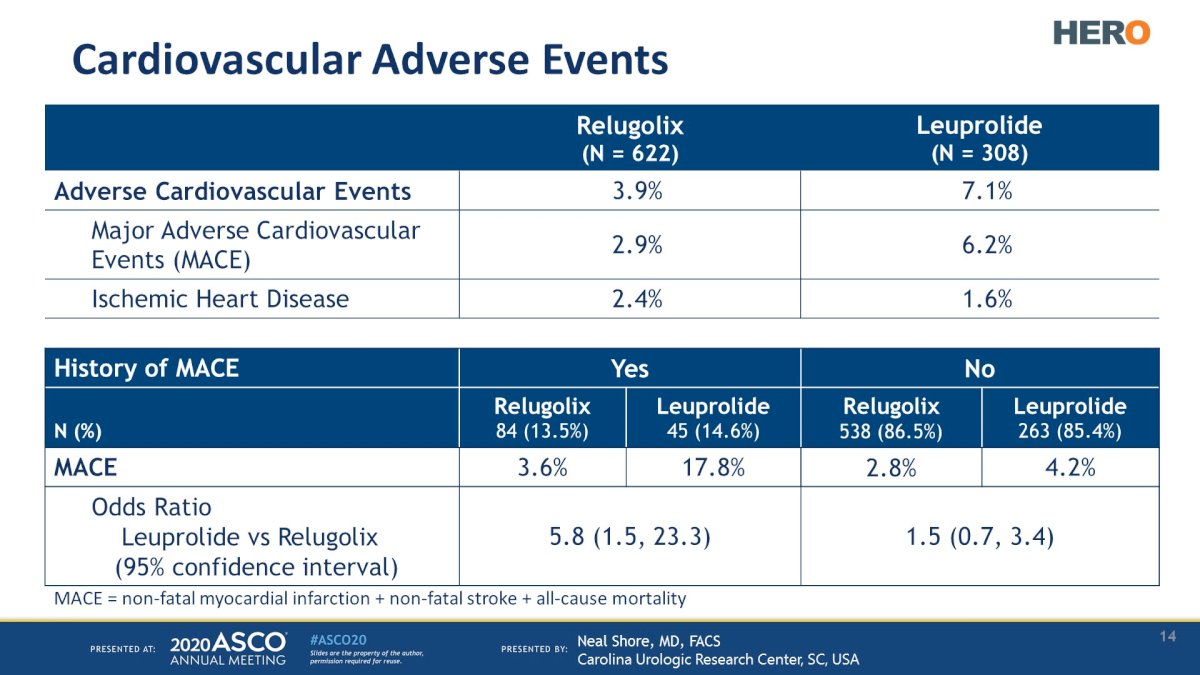
En particular, el 93% de los pacientes de este ensayo tenían factores de riesgo cardiovascular preexistentes.
Entre los hombres que recibieron relugolix, el 97 % mantuvo la castración a las 48 semanas, en comparación con el 89 % de los hombres que recibieron leuprolida. Una diferencia de 7,9 puntos porcentuales (IC del 95 %: 4,1 a 11,8) demostró la no inferioridad y la superioridad de relugolix (P <0,001 para la superioridad).
Vale la pena señalar que los pacientes que usaron Relugolex tuvieron un riesgo 54 % menor de sufrir eventos cardiovasculares adversos importantes.
Este beneficio fue más pronunciado en pacientes con antecedentes de un evento cardiovascular adverso importante (3,6% frente a 17,8%).5
En 2021 se publicaron los resultados del ensayo aleatorizado PRONOUNCE que compara la seguridad cardiovascular de degarelix frente a leuprolida en pacientes con cáncer de próstata. No se observaron diferencias estadísticamente significativas entre los pacientes tratados con degarelix (5,5%) versus leuprolida (4,1%; HR: 1,28, IC 95%: 0,59 – 2,79, P = 0,53). Sin embargo, hubo varias limitaciones importantes en este ensayo. El reclutamiento fue más lento de lo planeado originalmente y la tasa de eventos de resultado primario fue menor de lo esperado. El patrocinador ha cerrado la inscripción con 545 participantes de los 900 reclutados.
El estudio RADICAL PC identificó prospectivamente a 2492 hombres consecutivos (edad media 68 años) con cáncer de próstata (recién diagnosticado o que planeaban TDA por primera vez) de 16 sitios canadienses. El riesgo cardiovascular se estimó mediante el cálculo de las puntuaciones de riesgo de Framingham. La mayoría (58%) eran fumadores o exfumadores, el 22% tenía enfermedades cardiovasculares, el 16% diabetes, el 45% hipertensión, el 31% IMC ≥30 kg/m.2 o más, y el 24% tiene niveles bajos de actividad física. Curiosamente, los pacientes con más factores de riesgo cardiovascular tenían más probabilidades de recibir ADT en este estudio. Esto puede deberse a la edad avanzada y el nivel socioeconómico más bajo en el grupo con alto riesgo de cáncer de próstata que planeaban recibir ADT.6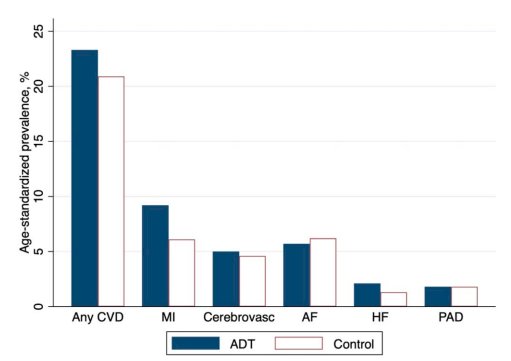
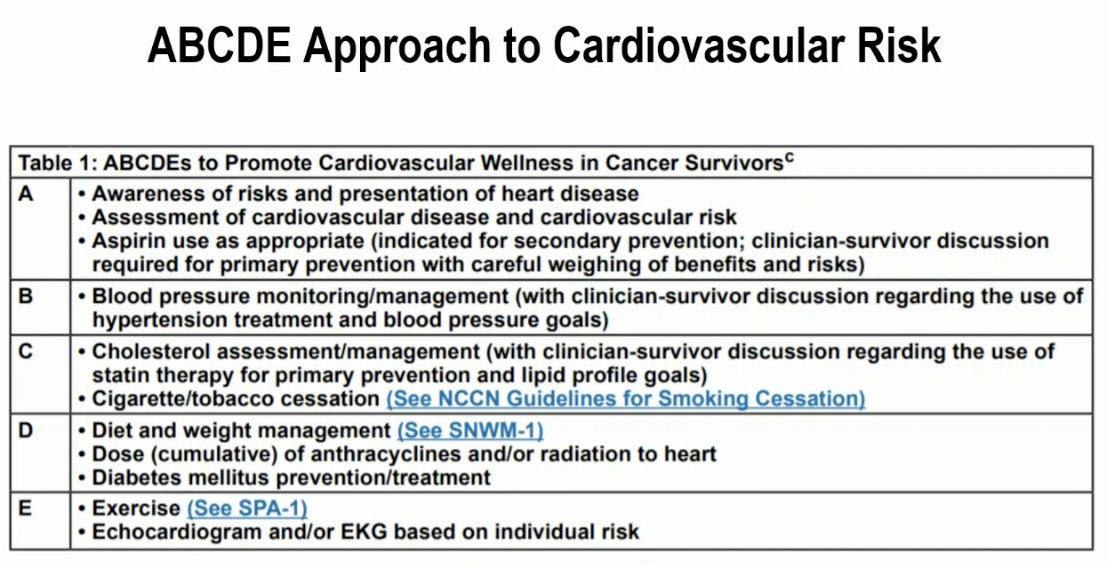
Las directrices de la NCCN recomiendan actualmente un enfoque sistemático “ABCDE” para abordar los factores de riesgo cardiovascular en pacientes con cáncer, como se resume a continuación:
La Dra. Morgans concluyó su presentación con los siguientes mensajes:
- La ADT farmacológica se puede administrar como tratamiento agonista o antagonista de GnRH
- Sus diferencias incluyen el método de administración y el aumento de testosterona, pero el control de la enfermedad es similar.
- La ADT afecta negativamente a los factores de riesgo cardiovascular y probablemente esté asociada con el riesgo de enfermedad cardiovascular.
- Los antagonistas de GnRH pueden estar asociados con un riesgo reducido de enfermedad cardiovascular en comparación con los agonistas de GnRH
- El manejo sistemático de los factores de riesgo cardiovascular es un enfoque recomendado para brindar una atención cardiovascular óptima a los pacientes.
Presentado por: Alicia K. Morgans, MD, MPH, Profesor Asociado, Departamento de Medicina, Director Médico del Programa de Supervivencia del Instituto del Cáncer Dana-Farber, Hospital General de Massachusetts, Boston, Massachusetts
Escrito por: Rashid K. Syed, MD, MSc – Miembro clínico de la Sociedad de Oncología Urológica (SUO) de la Universidad de Toronto, @rksayyid en Twitter durante la Reunión Anual de la Sociedad de Oncología Urológica (SUO) de 2023 celebrada en Washington, DC entre el 28 de noviembre.y y el 1 de diciembrecalle2023
Referencias:
- SAYLOR BIGAY, SEÑOR SMITH. Complicaciones metabólicas de la terapia de privación de andrógenos para el cáncer de próstata. J Urol. 2004;181(5):1998-2006.
- Albertsen BC, Klotz L, Tomball B, et al. Morbilidad cardiovascular asociada a la secreción de gonadotropinas, agonistas y antagonistas. Euro Urol. 2014;65(3):565-573.
- Margel D, Cerveza A, Cerveza Y, et al. Morbilidad cardiovascular en un ensayo aleatorizado que compara un agonista de GnRH y un antagonista de GnRH entre pacientes con cáncer de próstata avanzado y enfermedad cardiovascular preexistente. J Urol. 2019;202(6):1199-1208.
- Cerne F, Agile N, Petropoulos G, et al. Efectos cardiovasculares de los antagonistas de la hormona liberadora de gonadotropina en hombres con cáncer de próstata. Eur Heart J Cardiovasc Pharmacother. 2022;8(3):253-262.
- Shore ND, Saad F, Cookson MS, et al. Relugolix oral para el tratamiento de la privación de andrógenos en el cáncer de próstata avanzado. N Inglés J Med. 2020;382(23):2187-2196.
- Leung DP, Fradit V, Shaygan B, et al. Riesgo cardiovascular en hombres con cáncer de próstata: conocimientos del estudio radical de PC. J Urol. 2020;203(6):1109-1116.

“Defensor de la Web. Geek de la comida galardonado. Incapaz de escribir con guantes de boxeo puestos. Apasionado jugador”.