Los fragmentos de anticuerpos inhalados ofrecen una amplia protección contra las variantes del SARS-CoV-2
Los anticuerpos neutralizantes se usan ampliamente para tratar la enfermedad por coronavirus 2019 (COVID-19) causada por el síndrome respiratorio agudo severo viral 2 (SARS-CoV-2). Sin embargo, este enfoque de tratamiento está asociado con varias limitaciones, incluida la incapacidad para esterilizar la mucosa del sitio de precipitación viral, la aparición de variantes resistentes a los anticuerpos y los altos costos.
nuevo Terapia Molecular El estudio describe un posible nuevo enfoque para tratar la COVID-19 en forma de pequeños anticuerpos humanos que pueden usarse como nanocuerpos pero con un nivel de riesgo más bajo.
estancia: Los fragmentos de anticuerpos humanos inhalables neutralizan las variantes del SARS-CoV-2 para el tratamiento de la COVID-19. Haber de imagen: Huen Estructura Bio/Shutterstock.com
Introducción
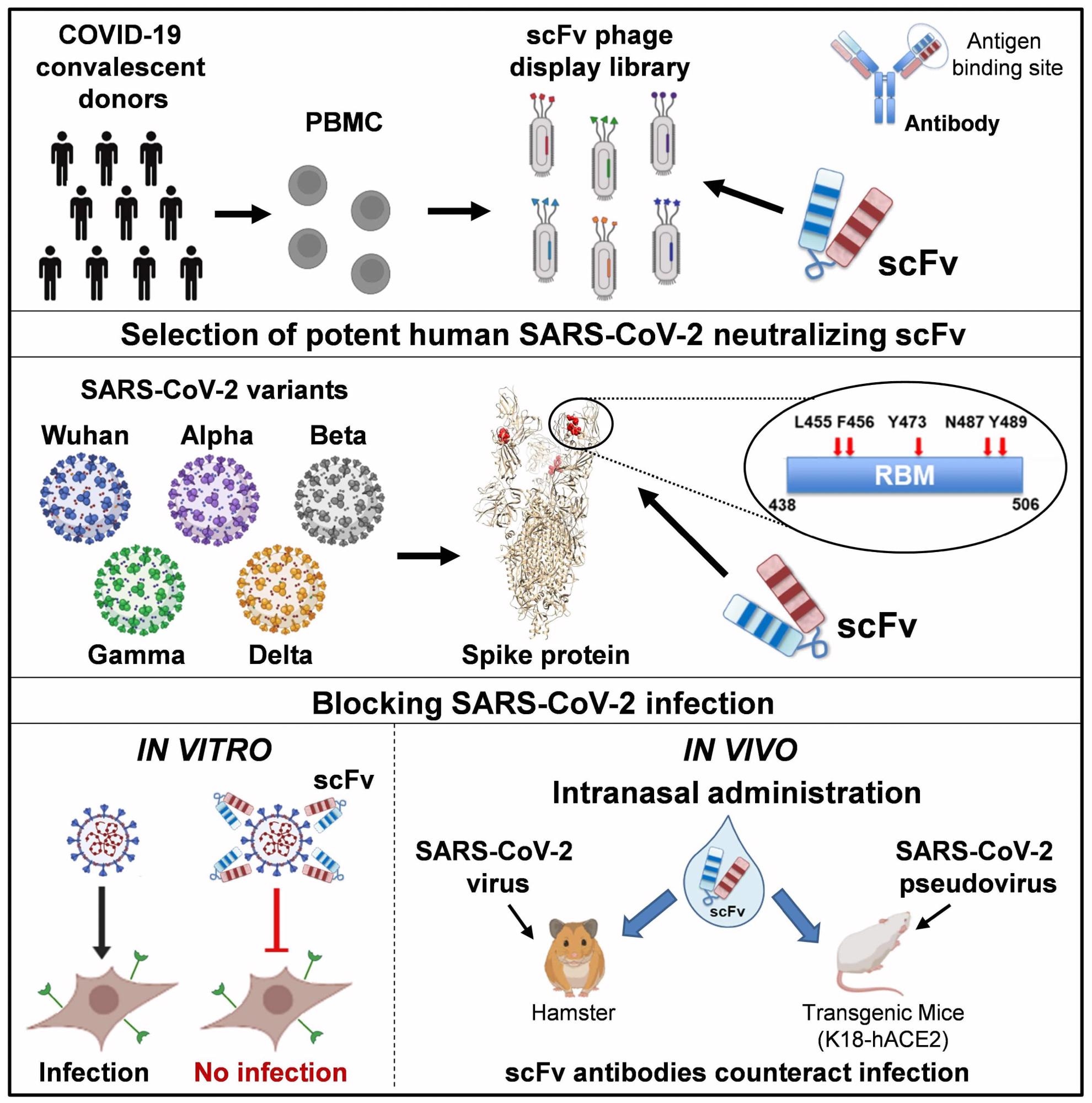
Inicialmente, los nanocuerpos de un solo dominio basados en la región variable del anticuerpo de cadena pesada anti-SARS-CoV-2 se consideraron como un posible método terapéutico para uso inhalado en comparación con los anticuerpos monoclonales sistémicos. Estos nanocuerpos son de origen camello y, por lo tanto, deben humanizarse mediante procesos potencialmente costosos y de reducción de escala.
El estudio actual se centra en los pequeños anticuerpos humanos generados mediante la ingeniería de inmunoglobulina variante ligera (Ig) y la secuenciación pesada juntas, formando un solo polipéptido polipeptídico pequeño mediante el uso de un conector peptídico flexible. El ligando permite que los dominios de unión a antígeno funcionales se reconstituyan en anticuerpos variables de fragmento de cadena única (scFv).
En particular, los anticuerpos scFv no contienen la parte cristalizable (Fc) de la molécula de anticuerpo y, como consecuencia, no provocan una mejora dependiente de anticuerpos (ADE) de la enfermedad. Además, los anticuerpos scFv tampoco requieren costosos sistemas de expresión en mamíferos y se pueden producir rápidamente a gran escala, lo que los hace mucho más baratos de producir que los anticuerpos monoclonales convencionales.
Estos polipéptidos simples, no glicosilados, son moléculas simples, pequeñas y muy estables. Entre el conjunto de anticuerpos, se seleccionaron por su unión, afinidad e inhibición aquellos que mostraron interacción con el pico S1 del SARS-CoV-2, las proteínas del dominio de unión al receptor (RBD) del delta SARS-CoV-2 y otras variantes monitoreadas (VBM). . La mayoría de las mutaciones existentes se incluyeron en las variantes de preocupación actualmente conocidas.
Todas las variantes de pico y RBD se identificaron de manera eficiente y se unieron al anticuerpo de bloqueo de scFv76 (76clAbs), que comprende los derivados de afinidad maduros de scFv76. La afinidad de scFv76 superó la de los anticuerpos scFv5 y scFv86, lo que probablemente se deba a los diferentes epítopos de los dos últimos anticuerpos. Los resultados de la resonancia de plasmones superficiales (SPR) también indicaron que los 76clAbs se unen a los mismos o muy cercanos epítopos, mientras que scFv5 se une a otro epítopo.
Todos los 76clAbs reconocen la proteína SARS-CoV-2 nativa y evitan su unión al receptor de la enzima convertidora de angiotensina 2 (hACE2), pero no a otros anticuerpos scFv. Con la excepción de scFv76-55, todos los 76clAbs internalizaron la variable delta y otras mutaciones de VBM sin perder su actividad neutralizante.
Las concentraciones inhibidoras disminuyeron en un 50 % (IC50) entre 0,36 y 4,30 nM (nM), lo que contrastaba con concentraciones superiores a 40 nM, por debajo de las cuales scFv5 y scFv86 permitían la elevación o la unión de RBD al receptor.
A través de experimentos de infección celular, 76clAbs suprimió la infección de pseudovirus que portaban pico delta, pico D614G o proteínas pico de varias variantes de interés (VOC) y VBM. Nuevamente, la actividad neutralizante más baja fue con scFv76-55, que mostró la mayor pérdida de actividad con mutaciones en RBD.
Al cambiar a experimentos con las variantes virales originales, los científicos encontraron que todos los 76clAbs también suprimieron el efecto citopático (CPE) con un título de neutralización preciso del 50 % (MN50) <15 nm en comparación con la variante delta.
Cuando se agregó 1 hora después de la inoculación del cultivo celular con cualquier variante de SARS-CoV-2, incluidas las cepas ancestrales de Wuhan, D614G y Alpha, se produjo una inhibición efectiva de todas las variantes. IC50 fue inferior a 22 nm.
Con una inoculación de virus de pretratamiento de una hora, IC50 fue menos de una décima parte de esto. Se observaron los mismos resultados utilizando sueros agrupados de seis donantes convalecientes de COVID 19, que muestran una amplia brecha de IC50 entre el pretratamiento y el postratamiento de las muestras inoculadas.
Estos anticuerpos también interrumpieron la fusión de membranas inducida por picos que media la entrada viral en las células huésped. Esto se considera una característica importante, ya que la formación de Pneumocystis carinii parece ser la lesión característica de esta infección y es en gran parte responsable de la inflamación local y el tromboembolismo. Sin embargo, a concentraciones nanomolares, scFv76 impidió la fusión con las tres variantes anteriores.
Los 76clAb también se asociaron con un epítopo del tipo de unión al receptor (RBM); Sin embargo, scFv86, un anticuerpo no neutralizante, reconoce otro epítopo con residuos críticos fuera del RBM. El bucle de unión de 76clAb incluye los residuos F456, Y473, N487 e Y489, ninguno de los cuales está mutado en la variante Delta, ninguna variante de elevación de VBM o incluso la variante Omicron, aunque la última cepa de SARS-CoV-2 tiene la mayor cantidad de Mutaciones RBD. .
De hecho, Omicron evita los anticuerpos neutralizantes en los sueros inmunitarios y la mayoría de los anticuerpos monoclonales anti-RBD. Sin embargo, todos los residuos permanecieron intactos, lo que indica la naturaleza altamente conservada de este epítopo.
Este grupo de anticuerpos contiene dos tipos en las formas mono y diméricas de scFv76, siendo las más estables scFv76, scFv76-46 y scFv76-58. A 90 °C, la estructura de hoja beta plegada de estas proteínas se despliega. Por lo tanto, estos anticuerpos se nebulizan sin perder su integridad, naturaleza proteolítica o capacidad para unirse a la proteína del pico del SARS-CoV-2.
La administración intranasal de scFv76 a 37 μg/fosa nasal en un modelo de ratón transgénico suprimió completamente la infección viral cuando se administró dos horas antes o cuatro horas después de la infección. Los hámsteres también estaban protegidos de la enfermedad clínica cuando se administraban dosis similares 2 horas antes y luego una vez al día durante 2 días después de la infección.
Otras pruebas demostraron que, en forma vaporizada, el scFv76 puede administrarse de manera eficaz en los espacios alveolares, y la cantidad depositada se acumula con el tiempo.
Monumentos
Aquí describimos una clase de anticuerpos humanos anti-SARS-CoV-2 scFv con eficacia neutralizadora de subnanopartículas, eficacia in vivo y estabilidad significativa. Estos pequeños anticuerpos humanos completos son candidatos prometedores para el tratamiento temprano de COVID-19 como un enfoque complementario a la vacunación actual y la inmunización sistémica pasiva, que no inducen una defensa mucosa robusta.. “

“Defensor de la Web. Geek de la comida galardonado. Incapaz de escribir con guantes de boxeo puestos. Apasionado jugador”.