Las relaciones entre la tasa de crecimiento y el metabolismo mitocondrial varían con el tiempo
Los experimentos fueron aprobados por el Comité de Ética francés responsable de los experimentos con animales (Nº 2019072411491441) y se realizaron de acuerdo con las directrices institucionales y ARRIVE.
Recolección y cría de animales.
En mayo de 2019, juveniles de lubina europea, Dicentrarchus laprax (Linnaeus 1758) (6 meses, masa 5 g), fue trasladado de una piscifactoría (Turbot Ichtus, Trédarzec, Francia) a la instalación de cría de Ifremer (Plouzané, Francia). Los peces se mantuvieron en un tanque general durante 5 meses, se mantuvieron en un fotoperíodo de 12 L: 12 días y se alimentaron a saciedad tres veces por semana utilizando gránulos comerciales (Neo Start, Le Gouessant, Lamballe, Francia).
En octubre de 2019, se anestesiaron peces (n = 40) (Tricaïne; 125 mg l .).−1), pesado (41,5 ± 1,8 g, MCE11201S-2S00-0, Sartorius, Göttingen, Alemania) e implantado por vía subcutánea con una etiqueta de identificación (RFID, Biolog-id, Bernay, Francia). Luego, los peces se distribuyeron aleatoriamente en diez tanques replicados de 400 l equipados con agua de mar de flujo abierto completamente aireada (saturación de oxígeno> 95%, salinidad 32 ppt), termorregulados durante el invierno para evitar caer por debajo de 13 ° C y alimentados cuando estaban satisfechos. tres veces a la semana. La temperatura se registró semanalmente. Para calcular el efecto potencial del cambio de temperatura durante el transcurso del experimento (15,5 ± 0,5 °C, rango: 13,1–17,9 °C) sobre el crecimiento, se realizó un análisis de correlación entre la temperatura y la tasa de crecimiento específica (SGR). No se encontró relación estadística entre SGR y temperatura (Spearman s2= 0,060, s = 0,596). Peces adicionales (n = 40) estaban presentes en los tanques (densidad final: n = 8 por tanque) por la necesidad de otro proyecto.
medidas de crecimiento
La masa corporal (BM) se midió aproximadamente cada cuatro semanas desde octubre de 2019 hasta junio de 2020. Los peces se mantuvieron en ayunas durante 48 h y se anestesiaron antes de cada medición de BM (± 0,1 g). Tasa de crecimiento específica (% día-1) Como sigue:
$${\text{Tasa de ~crecimiento ~específico}} = ~\frac {{\ln\left({~BM final} \right) – \ln\left({~BM inicial} \right)}}{{ {\text{días~transcurridos}}}}\100 veces $$
En marzo de 2020, se recolectó una muestra de biopsia de músculo rojo de peces para medir los rasgos metabólicos mitocondriales. El crecimiento ex se definió como tasas de crecimiento específicas antes del análisis de los rasgos metabólicos mitocondriales (tasa de crecimiento específica ex, SGR).pasado). SGRpasado Se contaron utilizando MO en biopsia muscular como MO final y MO a las 7, 11, 16 y 20 semanas antes de la biopsia muscular como MO primario (Figura 1). El crecimiento futuro se definió como tasas de crecimiento específicas después de analizar los rasgos metabólicos mitocondriales (Future Specific Growth Rates, SGR).futuro). SGRfuturo Se calculó utilizando la MO a las 4, 8 y 12 semanas después de la biopsia muscular como la MO final y la MO en la biopsia muscular como la MO inicial. En la lubina europea, la mayor parte del crecimiento físico ocurre durante los primeros 3 a 5 años de vida, por lo que varios meses de medición del crecimiento en la etapa juvenil pueden ser representativos del crecimiento general del animal.
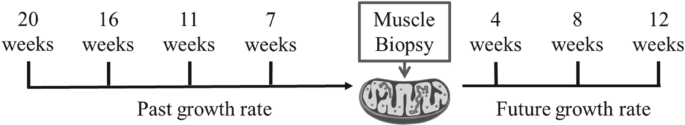
Diseño experimental. Se pesaron lubinas jóvenes (n = 40) aproximadamente cada cuatro semanas durante un período de 32 semanas. En la semana 20, se utilizó una biopsia de músculo rojo para examinar las mitocondrias. Las tasas de crecimiento específico (SGR) se calcularon en relación con el momento de la biopsia. La tasa de crecimiento pasada corresponde a la SGR calculada antes de la biopsia y la tasa de crecimiento futura corresponde a la SGR calculada después de la biopsia.
Biopsia muscular
La biopsia muscular se realizó como un método no letal de muestreo de tejido para examinar las mitocondrias y, al mismo tiempo, permitirnos determinar la tasa de crecimiento en el futuro. Los peces se anestesiaron con tricaína (como se indicó anteriormente), se pesaron (76,7 ± 3,6 g) y se tomó una biopsia. Se realizó una incisión cutánea (<10 mm de longitud) con bisturí por debajo de la línea lateral y entre la aleta dorsal y caudal. A continuación, se extrajo un corazón del músculo rojo mediante una punción de biopsia (2 mm LCH-PUK-20, Kai Medical, Solingen, Alemania). El núcleo del músculo rojo se limpió inmediatamente del músculo blanco con un bisturí. A continuación, se pesó la muestra de músculo rojo (5,6 ± 0,2 mg; AC210P-0F1, Sartorius, Göttingen, Alemania) y se transfirió a un tampón de respiración helado (20 mmol L).−1 Taurina, 10 mmol l−1 KH2s420 mmol l−1 HEPES, 110 mmol l−1 D-sacarosa, 60 mmol L−1 K-lactobionato, 1 g l−1 libre de BSA, pH 7,0 a 13°C). La herida se desinfectó (Vétédine®Solution, Vetoquinol, Magny-Vernois, France) y se rellenó con un apósito en polvo (ORAHESIVE, ConvaTec®, Deeside, UK). El pez se colocó en el tanque de recuperación antes de regresar al tanque original.
El procedimiento de muestreo recientemente desarrollado para examinar las mitocondrias requiere muchos trabajos preliminares. Una prueba piloto en un grupo diferente de peces evaluó los efectos inmunológicos de la biopsia sobre la inflamación por infección bacteriana o tejido dañado. No hubo un efecto significativo de la biopsia en el sistema inmunitario (consulte Materiales y métodos complementarios para obtener detalles de todos los protocolos de detección y los resultados, Figura S1b). Este experimento también mostró que la biopsia redujo ligeramente la tasa de crecimiento pero los peces continuaron ganando masa (Fig. S1a). Finalmente, los peces requirieron anestesia para realizar la biopsia, y la tricaína se considera la más prudente para estudiar las mitocondrias en el músculo de los peces. Tricaine funciona al bloquear los canales de sodio dependientes de voltaje e inhibir los potenciales de acción neuronal23. Los canales de sodio intramusculares son relativamente insensibles a la tricaína23, lo que indica que es poco probable que la tricaína afecte la fisiología de las células musculares. Sin embargo, sería apropiado probar el efecto potencial de la tricaína sobre la función mitocondrial en el músculo de pescado.
Homogeneización de tejidos para ensayo mitocondrial
Inmediatamente después de la biopsia, las muestras de músculo se cortaron con tijeras de microdisección para obtener una solución homogénea con un tamaño de partícula de <0,5 mm (probado con pipeta a través de una punta de 1 ml), un procedimiento de homogeneización adaptado de24. La preparación de tejido por corte utilizada aquí permitió una permeabilidad muscular rápida y eficiente, sin pérdida de tejido, manteniendo la calidad mitocondrial. Las verificaciones del método de permeabilización se describen en11,25. Los congéneres se diluyeron más en solución de espirometría para obtener una concentración final de 1 mg ml−1 (media ± se = 1,0 ± 0,2 mg ml−1). La homogeneización del músculo rojo se realizó en hielo. Solo se pudieron ejecutar cuatro peces simultáneamente para el ensayo mitocondrial (una medición por pez), y se realizaron dos operaciones por día; Por lo tanto, se necesitaron cinco días para analizar los cuarenta peces.
Medición de las propiedades metabólicas mitocondriales
El consumo de oxígeno y magnesio verde fluorescente se detectó simultáneamente en cuatro cámaras de espirometría (2 ml, cámara por pez) equipadas con sensores fluorescentes y se registró con el software DatLab (Oroboros Instruments, Innsbruck, Austria) a 13 °C con agitación constante. Inmediatamente después de la homogeneización y dilución, se añadieron 2,2 ml del homogeneizado a una de las cuatro cámaras. Los rasgos metabólicos mitocondriales se determinaron utilizando el método descrito por chinopoulos,et al.26. Primero, inhibidor de adenilato quinasa (P1, P5-Di(adenosina-5′) sal de pentafosfato, 0.1 mmol l−1), sustratos complejos ligados a I (5 mmol de piruvato l ).−1 Malato 0,5 mmol L−1) y MgGreen (2,2 μmol l .).−1) para cada pozo. Después de la adición de EGTA (0,1 mmol l−1) y EDTA (15 μmol l .).−1), la señal fluorescente de MgGreen se calibró usando diez inyecciones consecutivas de MgCl2 (1 mmol l−1). Succinato (10 mmol L−1) para proporcionar al Compuesto II sustratos de energía. La respiración de OXPHOS y la producción de ATP se midieron añadiendo ADP (2 mmol l).−1). La fuga respiratoria se midió mediante la inhibición de la síntesis de ATP mediante la adición de carboxyatraquilósido (4 μmol l.−1). La tasa de desaparición de ATP debida a la actividad ATPasa también se midió en estas condiciones. Esta medida se sustrajo de la producción de ATP medida durante la respiración OXPHOS. Inhibidor de la coenzima Q-citocromo c reductasa (CIII), antimicina A (2,5 µmol L−1), luego agregó. Esta medida se restó de otras tasas de respiración mitocondrial para corregir el consumo de oxígeno no relacionado con la actividad de la cadena respiratoria. Finalmente, se estimó la densidad mitocondrial con actividad COX mediante la adición de ascorbato (8 mmol l .).−1) seguido de N,N,N,N-tetrametil-p-fenilendiamina (TMPD; 0,5 mmol l).−1) para habitaciones. La tasa de producción de ATP y la relación ATP/O se calcularon como se describe en Salin, et al.27. Brevemente, convertimos la señal fluorescente de la concentración de Mg libre en la de ATP. Usamos la misma afinidad de unión (K.Dr) para magnesio2+ Se une a ATP y ADP como en Thoral et al.28 Debido a que los análisis mitocondriales se realizaron en las mismas condiciones de temperatura y concentración de homogeneización (K.D-ATP = 0,266 mmol l−1kD-ADP = 1,803 mmol l−1). La relación ATP/O se calculó como la relación entre la producción de ATP y la respiración de OXPHOS. Las tasas de consumo de oxígeno y producción de ATP se expresaron como pmol s– 1 miligramos– 1 toallita mojada
En un experimento adicional, determinamos la redundancia técnica de los rasgos metabólicos mitocondriales. Las mediciones duplicadas de los rasgos metabólicos mitocondriales para dos biopsias del mismo individuo fueron altamente reproducibles (coeficientes de correlación entre filas: respiración OXPHOS). s= 0,41, s< 0.001; fuga de aliento s= 0,48, s< 0.001; Actividad de Cox: s= 0,40, s< 0.001; n = 19; producción de ATP s= 0,44,s=0.001; n = 14).
análisis estadístico
Se utilizó la correlación intraclase (ICC) para evaluar las diferencias consistentes en las tasas de crecimiento entre individuos antes y después del examen mitocondrial. La consistencia individual de la tasa de crecimiento se probó entre la duración más similar en un experimento de crecimiento, es decir, SGRpasado A las 7 y 11 semanas se asoció a SGRfuturo A las 8 y 12 semanas, respectivamente. Se utilizaron modelos mixtos lineales (LMM) para determinar las relaciones entre la tasa de crecimiento de los peces y los rasgos metabólicos mitocondriales. Todo SGR (SGRpasadoMás de 7, 11, 16 y 20 semanas y SGRfuturodurante 4, 8 y 12 semanas) se ejecutó en modelos separados. Los modelos incluyeron SGR como variable dependiente, respiración OXPHOS, producción de ATP, respiración LEAK y actividad COX como predictores continuos, con la pecera como factor aleatorio. Para controlar el efecto de la masa corporal inicial sobre la tasa de crecimiento, se incluyó la masa corporal inicial como covariable en cada modelo. Hoy y el proceso de procesamiento para el ensayo mitocondrial, así como el aparato de Oroboros y la cámara de espirometría utilizada para el análisis del ensayo mitocondrial se incluyeron inicialmente como posibles factores aleatorios en cada modelo, pero no fueron significativos y luego se eliminaron. También probamos si el grado de eficiencia de las mitocondrias en la generación de ATP, determinado por la relación ATP/O, explicaba la variación individual en el crecimiento, que tenía que examinarse en un modelo lineal separado para evitar problemas asociados con múltiples pasos entre ATP/O , respiración OXPHOS y producción de ATP.
Como la densidad mitocondrial puede influir en las tasas de masa específicas para los rasgos metabólicos mitocondriales (correlaciones de Pearson: todo r > 0,37 ys< 0,05) y SGR. La estimación de los rasgos mitocondriales independientes de COX se utilizó en los análisis LMM primarios de SGR. Los residuos se calcularon a partir de regresiones lineales separadas relacionadas con los rasgos metabólicos mitocondriales (p. ej., OXPHOS, respiración LEAK y producción de ATP) para la actividad COX. Como antes, usamos LMM con SGR como variable dependiente e independiente OXPHOS y LEAK para respiración, producción de ATP independiente de COX y actividad de COX como predictores continuos. Como los patrones de los resultados de los análisis de la tasa de crecimiento fueron los mismos si los rasgos metabólicos mitocondriales se midieron en términos de tejidos específicos o independientes de la COX, solo los rasgos metabólicos mitocondriales se informaron en términos de grupo.
Todos los análisis se basaron en un tamaño de muestra de 40 peces y todos los análisis estadísticos se realizaron utilizando R (4.0.3; paquete lme4; fracción de paquete R2). Los datos se presentan como medias ± SEM, nivel de significación establecido ens< 0.05, inclusive R2 (IR2) para ilustrar la varianza explicada por un predictor en un modelo29.

