Evaluación toxicológica de la sobredosis de hidroxicloroquina en embriones de pez cebra (Danio rerio)
Defectos de crecimiento inducidos por HCQ
índice de mortalidad
Mortalidad de embriones de pez cebra a las 8 h después de la fertilización (hpf) y 1 día después de la fertilización (dpf), 2 dpf, 3 dpf y 4 dpf por debajo de 0 μM, 12,5 μM, 25 μM, 50 μM, 100 μM y 200 μM HCQ que se administró a 0 hp.
La mortalidad acumulada de los grupos control y experimental con concentraciones de HCQ que no superaban los 50 μM se mantuvo baja (p > 0,05) de la siguiente manera: 0 μM (0,0 %), 12,5 μM (5,9 %), 25 μM (3,6 %) y 50 μM µM (0,0%). Antes de completar 1 dpf, la mortalidad del grupo experimental a concentraciones superiores a 50 μM se mantuvo baja. Sin embargo, al llegar a 1 dpf, la mortalidad acumulada a 100 μM aumentó significativamente al 26,8 % (p < 0,05). La mortalidad a 200 μM aumentó significativamente a 81,2 % a 1 dpf, 89,6 % a 2 dpf y alcanzó un máximo de 93,8 % a 3 dpf (p < 0,05) (fig. 1a).
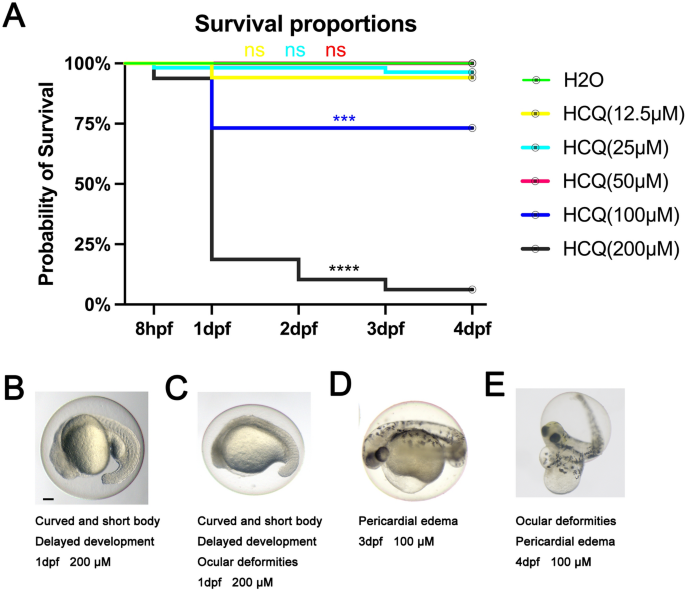
Curvas de supervivencia de embriones de pez cebra expuestos a diferentes concentraciones de HCQ desde 8 hpf hasta 4 dpf. Las líneas de diferentes colores representan diferentes grupos y el verde representa el grupo de control. (a) Se utilizó la prueba t no pareada para probar la significación estadística *P < 0,05; ** p < 0,01; ***P < 0,001; ****P < 0,0001, como se muestra a continuación. (B–miLas imágenes son ejemplos de anomalías del desarrollo. Barras de escala, 100 µm.
distorsión
Si bien se encontró que los fetos en el grupo de control se desarrollan normalmente durante todos los períodos de exposición. El grupo HCQ desarrolló anomalías a concentraciones superiores a 50 μM. Como se muestra en la Figura 1B-E, estas anomalías incluían anomalías en la cola, escoliosis, anomalías en la yema, retraso en el desarrollo, edema pericárdico y anomalías oculares, siendo las dos últimas las más evidentes. De manera similar al efecto observado en términos de mortalidad fetal, la gravedad de las malformaciones, incluido el edema pericárdico, las anomalías del saco vitelino y las anomalías oculares, aumentó con el aumento de las concentraciones de HCQ. Los fetos expuestos a HCQ 200 μM mostraron las anomalías más graves.
tasa de eclosión
A los 3 dpf, la tasa de eclosión para el grupo de control fue del 89 %. A concentraciones de HCQ por debajo de 50 μM, la tasa de eclosión fue del 71 % (12,5 μM), 91 % (25 μM) y 68 % (50 μM). A concentraciones superiores a 50 µM, la tasa de eclosión disminuyó rápidamente al 32 % (100 µM) y al 6 % (200 µM) (Fig. 2b), lo que puede estar relacionado con el aumento de la mortalidad embrionaria (26,8 % a 100 µM, 93,8 % )% a 200 μM) (Fig. 1a) a concentraciones similares de HCQ. A una velocidad de 96 hpf, se encontró que todos los embriones vivos no tenían enfermedad de Crohn (Fig. 2b).
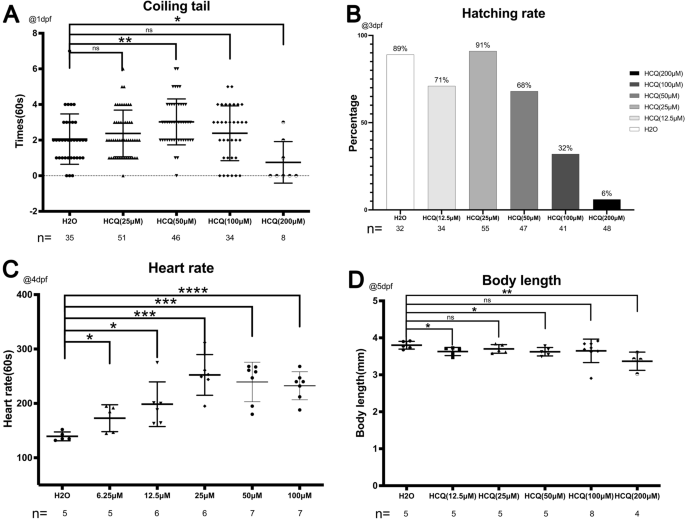
(a) Diagrama de dispersión y resultados estadísticos para el conteo de bobinas de cola a 1 dpf. (B) Diagrama de dispersión y resultados estadísticos de la tasa de eclosión a 3 dpf. (C) Diagrama de dispersión y resultados estadísticos de frecuencia cardíaca a 4 dpf. (Dr) Diagrama de dispersión y resultados estadísticos para la longitud del cuerpo a 5 dpf.
ritmo cardiaco
Las frecuencias cardíacas de los embriones de pez cebra se registraron a los 4 dpf. Para ello, se registraron las frecuencias cardíacas de los fetos seleccionados de cada grupo durante 20 s después de la estabilización del latido cardíaco fetal a temperatura ambiente durante 10 min.9.
La frecuencia cardíaca del grupo de control fue de 139,4 ± 8,1 latidos por minuto, que aumentó a 172,8 ± 24,7 (6,25 μM), 198,5 ± 41,0 (12,5 μM), 252,3 ± 37,4 (25 μM), 239,4 ± 36,4 (50 μM) , y 232,4 ± 25,8 (100 μM) bpm después de la exposición a HCQ, lo que demuestra que HCQ afecta la contractilidad cardíaca de los embriones de pez cebra.
Estos resultados indican que HCQ aumenta significativamente la frecuencia cardíaca de los embriones de pez cebra (p < 0,05), de forma dependiente de la dosis. Sin embargo, el efecto fue más lento a concentraciones superiores a 25 μM, lo que puede ser consecuencia del potencial cardiotóxico de altas concentraciones de HCQ.10,11 (Figura 2c).
longitud del cuerpo
Se encontró que la longitud del cuerpo del pez cebra disminuía con el aumento de las concentraciones de HCQ a los 5 dpf. Mientras que la longitud del cuerpo del pez cebra en el grupo de control fue de 3,8 ± 0,1 mm, la longitud del grupo experimental fue de 3,6 ± 0,1 mm (12,5 μm), 3,7 ± 0,1 mm (25 μm), 3,6 ± 0,1 mm (50 μm), 3,6 ± 0,3 mm (100 μm), 3,3 ± 0,2 mm (200 μm). Además, los grupos experimentales expuestos a HCQ 12,5 μM, 50 μM y 200 μM diferían significativamente del grupo de control, observándose la disminución más pronunciada en la longitud corporal a 200 μM (Fig.
comportamiento
Los movimientos fetales espontáneos se registraron en el saco vitelino durante 1 min a 1 dpf (Fig. 2a). El número de giros de cola por minuto en el grupo de control fue de 2,1 ± 1,4, que fue significativamente diferente de los observados a 25 μm (2,4 ± 1,3 veces/min) y 100 μm (2,4 ± 1,5 veces/min). Mientras que el grupo de 50 μM (3,0 ± 1,3 veces/min) mostró un aumento significativo (p < 0,005), el grupo de 200 μM (0,8 ± 1,2 veces/min) mostró una disminución significativa (p < 0,05).
Como se puede ver en el video complementario 1, los movimientos de las larvas en términos de distancia y velocidad de nado en el grupo HCQ mostraron una respuesta reducida a los estímulos externos en comparación con los del grupo de control a los 3 dpf. Este efecto fue cada vez más evidente con concentraciones crecientes de HCQ.
Además, reemplazando la solución experimental del grupo HCQ 50 μM con la misma agua de huevo que el grupo de control a los 3 dpf, observamos la restauración de la respuesta a los estímulos externos a los 4 pdf (24 h después). Por lo tanto, se puede inferir que HCQ está interfiriendo, aunque se puede revertir con movimientos espontáneos del pez cebra.
Hibridación in situ
Para determinar el efecto de HCQ en el desarrollo del tejido embrionario de pez cebra, se controlaron los grupos de control y los grupos tratados con HCQ 50 μM y 100 μM.
A las 5 hpf, la hibridación in situ completa (WISH) mostró un marcado aumento en los marcadores reguladores dorsales SGC Y el chd En embriones expuestos a HCQ 50 μM y 100 μM en la etapa de protección (p < 0,05). En estos grupos, HCQ alteró el destino de las células dorsales ventrales y expandió la región dorsal, lo que indica que podría regular el eje dorsoventral en el pez cebra. Por el contrario, la expresión del signo ventral Eva 1 No difirió significativamente entre los grupos de 50 μM (p> 0.05), 100 μM (p> 0.05) y control (Fig. 3a).
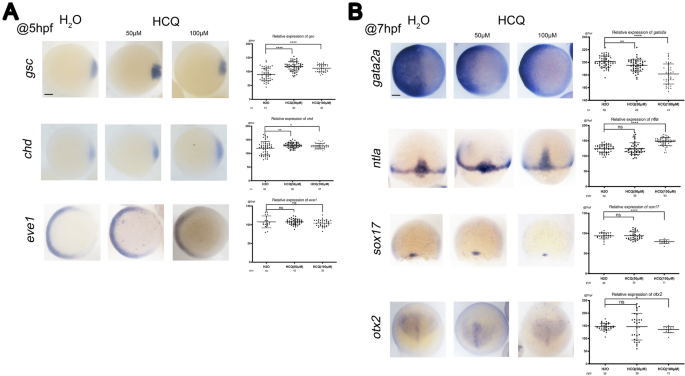
La expresión del marcador de la capa germinal fue detectada por ISH durante la gastrulación a las 5 hpf (a) y 7 HPF (B). Guía: leemos Y el sox17, vistas dorsales con la columna animal hacia arriba en el 75% de la etapa de epibolia; Vistas dorsales del animal con vista hacia arriba: otx2; Otros, exhibición de postes de animales (Eva 1Y el chdY el SGC Y el gata2a) con dorsal a la derecha. El gráfico de dispersión de la derecha corresponde a los resultados estadísticos de las señales de hibridación. Barras de escala, 100 µm.
Expresión de marcas en la piel gata2a Disminuyó en todo el ectodermo en la etapa de protección (etapa de 7 hpf) en los grupos de 50 μm (p < 0,05) y 100 μm (p < 0,05), y el pez cebra en estos grupos mostró una disminución significativa en el desarrollo del ectodermo (Fig. 3b) .
Además, similar a la observación realizada para los genes marcadores a las 7 hpf, el nivel de expresión del marcador mesodérmico leemos No fue significativamente diferente en el grupo de 50 μM (p > 0,05), pero aumentó significativamente en el grupo de 100 μM (p < 0,05) en comparación con el grupo de control. Por lo tanto, HCQ 100 μM regula el desarrollo del mesodermo del pez cebra (Fig. 3b).
signo de endodermo sox17 El signo del neuroectodermo anterior otx2 No difirió significativamente entre los grupos de 50 μM y de control (P > 0,05), pero se redujo significativamente en el grupo de 100 μM (P < 0,05). Por lo tanto, 100 μM de HCQ regula el desarrollo del endodermo del pez cebra (intestino, hígado y otros órganos internos) y el neuroectodermo anterior (Fig. 3b).
Prox1a Es un objetivo de la señalización de β-catenina-TCF/LEF en el ojo del pez cebra12Y el Pax2a Se expresa en varias estructuras, incluido el ojo inmaduro, el mesodermo, el sistema nervioso, la quilla nerviosa y el capilar. A 1 dpf, los niveles de expresión arroyos 1 un Y el pax2a No difirió significativamente entre los grupos de 50 μM y el grupo control (p > 0,05), pero se redujo significativamente en el grupo de 100 μM (p < 0,05). La disminución en la expresión de estos dos marcadores indica que HCQ reduce el desarrollo del ojo, el sistema nervioso y el sistema renal del pez cebra (Fig. 4a).
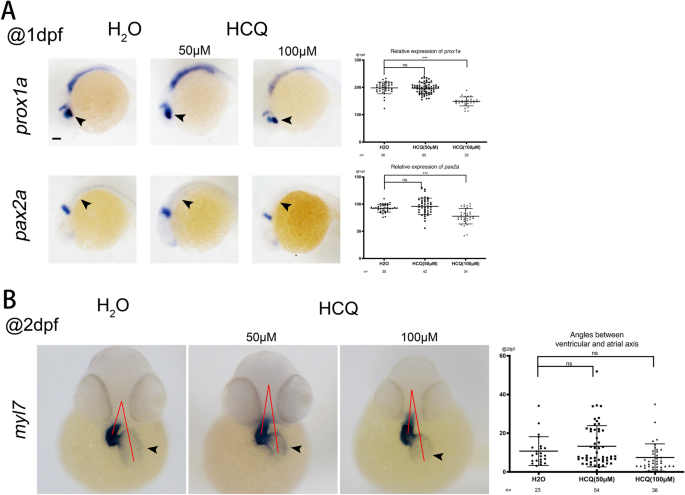
(a) expresión de signo a 24 hp. Vistas laterales frontales a la izquierda. (BMorfología cardíaca (caracterizada por el signo panmiocárdico myl7) a 48 hp. Orientación fetal: vista ventral con la parte anterior arriba. Las flechas apuntan al atrio. Las líneas rojas muestran el ángulo agudo formado entre los axones auriculares y ventriculares. El gráfico de dispersión de la derecha corresponde a los resultados estadísticos de los ángulos.
Myl7, el marcador cardíaco se expresa en los cardiomiocitos de todo el corazón. A 2 dpf, la expresión para myl7 No fue significativamente diferente entre el grupo de control, los grupos de 50 μM (p> 0.05) y 100 μM (p> 0.05) (Fig. 4b).
Análisis transcripcional
El mecanismo molecular del tratamiento con HCQ se analizó en términos de su efecto sobre los niveles de ARN fetal de pez cebra mediante un ensayo de transcriptoma (acceso a NCBI SRA: PRJNA879284).
El tratamiento con HCQ 50 μM dio como resultado la expresión diferencial de 960 transcritos, 581 de los cuales estaban regulados positivamente y 379 significativamente regulados positivamente en comparación con los del grupo de control (Fig. 5a y Tabla complementaria 1).
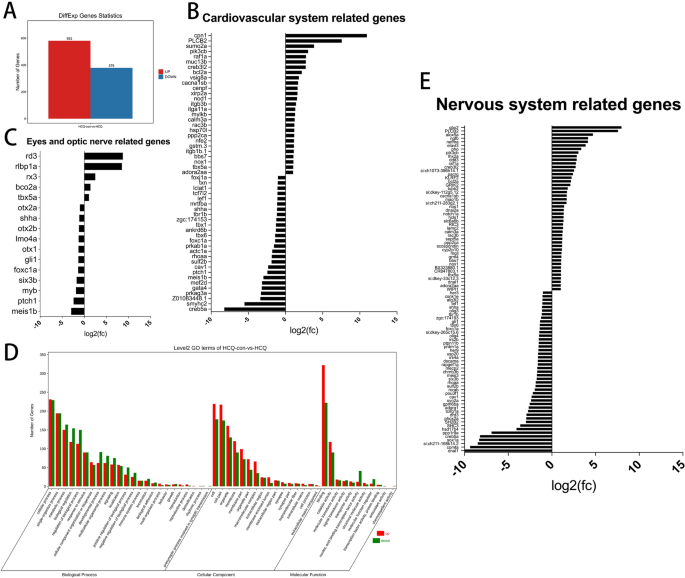
(a) Estadísticas generales sobre genes diferenciales. (B) genes significativamente diferenciales asociados con el desarrollo del sistema cardiovascular. (C) genes significativamente diferenciales asociados con el ojo y el desarrollo del nervio óptico. (Dr) El número de genes expresados de forma significativamente diferencial para procesos biológicos, componentes celulares y funciones moleculares. (mi) genes significativamente diferenciales asociados con el desarrollo del sistema nervioso.
El análisis de enriquecimiento de Gene Ontology (GO) reveló que la expresión génica relacionada con 24 procesos biológicos, 16 componentes celulares y 11 funciones moleculares se modificó significativamente (Fig. 5d). Entre los involucrados en procesos biológicos, 1322 genes mostraron una expresión aumentada y 1489 mostraron una expresión disminuida. Se encontró que el número de genes regulados y regulados relacionados con los componentes celulares era 1062 y 801, respectivamente. Se regularon al alza 518 genes adicionales y 424 genes se regularon al alza entre los relacionados con funciones moleculares (Fig. 5d y Tabla complementaria 2).
Dados los resultados de ISH y el desarrollo anormal del pez cebra como resultado del tratamiento con HCQ, analizamos específicamente la transcripción de sistemas específicos. Los resultados revelaron diferencias significativas en 53 genes relacionados con el desarrollo cardiovascular entre los grupos HCQ y el grupo de control, de los cuales 26 genes estaban regulados al alza y 27 genes estaban regulados al alza (Fig. 5b y Tabla complementaria 3).
Además, se encontraron diferencias significativas en la expresión de 16 genes relacionados con el desarrollo ocular entre los grupos HCQ y el grupo de control, en los que cinco genes estaban regulados al alza y 11 genes estaban regulados a la baja (Fig. 5C y Tabla complementaria 4). Encontramos diferencias significativas en 91 genes relacionados con el desarrollo del sistema nervioso en el grupo HCQ en comparación con el grupo control. 46 genes estaban regulados al alza y 45 genes estaban regulados a la baja (Fig. 5E y Tabla complementaria 4).
Para caracterizar las funciones de estas transcripciones expresadas diferencialmente, se realizó un análisis de clasificación basado en la ruta de la Enciclopedia de Genes y Genoma de Kyoto (KEGG) para la ontología de procesos celulares, procesamiento de información ambiental, procesamiento de información genética, enfermedades humanas, metabolismo y órganos. sistemas . Esto reveló que solo la vía de regulación de la longevidad se enriqueció significativamente en los embriones tratados con HCQ en comparación con los embriones de control (Fig. 6 y Tabla complementaria 5). Un estudio anterior demostró procesos mejorados de estrés oxidativo en el pez cebra debido a la exposición a HCQ.13. Encontramos dos genes, a saber nfe2 Y el pxdn, que intervienen en el proceso de estrés oxidativo. gene nfe2 También está involucrado en las vías del cáncer, las enfermedades cardiovasculares y el envejecimiento; Sin embargo, no se encontró que ninguna de estas vías estuviera significativamente enriquecida (Tabla complementaria 6).
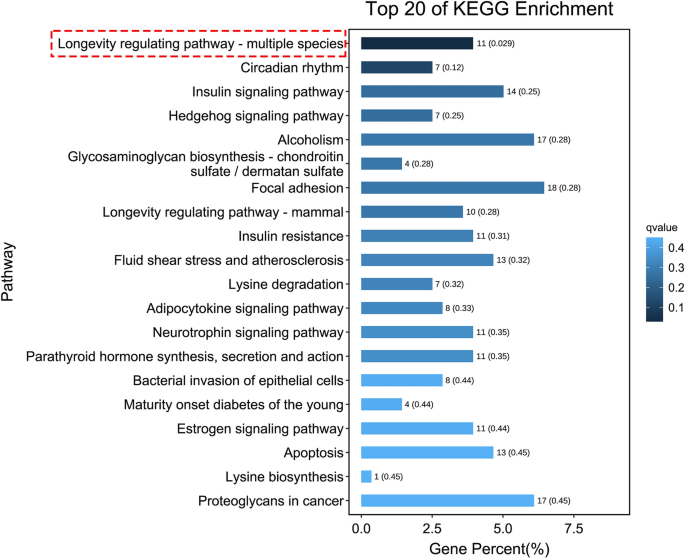
Las 20 mejores pistas KEGG enriquecidas, la pista identificada por el cuadro rojo discontinuo es la única pista significativamente enriquecida.

“Defensor de la Web. Geek de la comida galardonado. Incapaz de escribir con guantes de boxeo puestos. Apasionado jugador”.

