Los investigadores de Penn descubrieron un patrón molecular inesperado en FXS
FILADELFIA – Los investigadores han descubierto nuevos genes que funcionan mal y un patrón molecular inesperado, denominado BREACHes, vinculado al síndrome de X frágil (FXS). Es un trastorno genético estimado por los Centros para el Control y la Prevención de Enfermedades Afecta aproximadamente a 1 de cada 7.000 hombres y aproximadamente a 1 de cada 11.000 mujeres. El estudio realizado por investigadores de la Facultad de Medicina Perelman de la Universidad de Pensilvania, que utilizó células y tejido cerebral donados por pacientes, demostró que simplemente modificando la longitud de un patrón de repetición anormal podría restaurar genes silenciados en múltiples cromosomas. El estudio fue publicado este mes en celúla.
“Nuestros hallazgos tienen implicaciones para futuras estrategias de tratamiento para la frágil “estabilidad del genoma que también puede ser la base de otras enfermedades”. .
equipo liderado Gran autor Jennifer Phillips-Crimmins, Ph.D.profesor asociado de bioingeniería y genética, y miembro del Instituto de Genética de la Facultad de Medicina de la Universidad de Pensilvania, investigó FXS, la forma más común de discapacidad intelectual hereditaria, para comprender mejor la causa subyacente del trastorno. Los modelos de los libros de texto lo atribuyen al silenciamiento de un solo gen, Boletín de Migración Forzada1Y la pérdida de proteínas Boletín de Migración Forzada1 cifra, Ribonucleoproteína mensajera X frágil (FMRP). Se cree ampliamente que la pérdida de FMRP provoca una desregulación grave de las sinapsis, que conectan las células nerviosas en el cerebro, así como una alteración de la forma en que se expresan los genes en los núcleos de las células nerviosas.
El modelo pionero de FXS se basó en estudios con un ratón genéticamente modificado en el que… Boletín de Migración Forzada1 El gen fue expulsado. Sin embargo, al modelo de ratón le faltaba el impulsor genético crucial del FXS: una mutación llamada “expansión repetida”, que ocurre cuando una repetición larga de una secuencia de dos o más letras de ADN se vuelve inestable y anormalmente larga (una mutación de longitud repetida). .
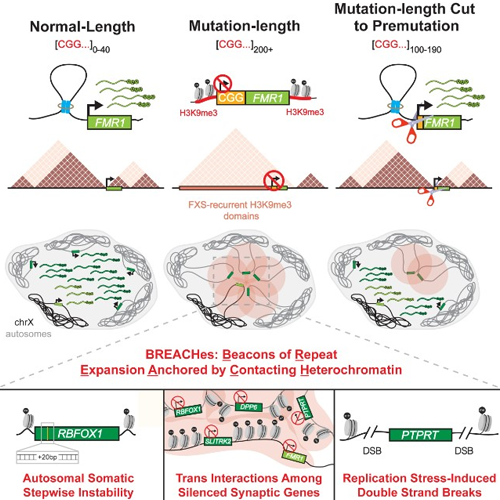
Para FXS, esta es la secuencia de tres caracteres (CGG) que aparece en un extremo de la pantalla. Boletín de Migración Forzada1 El gen. Mientras que la versión normal de Boletín de Migración Forzada1 tiene 40 o menos tripletes CGG en el tracto recurrente, un paciente con FXS tendrá 200 o más tripletes. Esta anomalía desencadena una respuesta defensiva de la célula, que esencialmente apaga Boletín de Migración Forzada1 y FMRP. Debido a la dificultad de diseñar secuencias repetitivas, los modelos de FXS en animales pequeños carecen del canal de replicación y, por lo tanto, es posible que no hayan demostrado aspectos importantes del papel del ADN repetitivo en los mecanismos subyacentes del FXS.
En su nuevo estudio, el equipo de investigación utilizó una combinación de técnicas avanzadas de secuenciación e imágenes, así como líneas celulares humanas y tejido cerebral con expansión repetida CGG, para revelar nuevos patrones sorprendentes de alteración del genoma en el FXS. Los investigadores descubrieron que grandes áreas de múltiples cromosomas en muestras de pacientes con FXS, que incluyen repeticiones CGG, se caracterizan por una heterocromatina silenciosa. Estos “dominios” de heterocromatina tienen forma de brechas: faros de expansión repetida y estabilización del contacto de heterocromatina.
Las brechas se agrupan en grupos de contacto físico en el núcleo y silencian genes implicados en las conexiones sinápticas, junto con genes asociados con la integridad de los tejidos conectivos como la piel y las articulaciones. Se ha observado disfunción del tejido sináptico y conectivo en pacientes con FXS en la clínica, por lo que la capacidad de identificar alteraciones tiene el potencial de ser una herramienta poderosa para encontrar genes alterados potencialmente importantes más allá de su alcance. Boletín de Migración Forzada1.
Los investigadores también probaron si las duplicaciones podrían estar directamente relacionadas con avances mediante el uso de la tecnología de edición de genes CRISPR-Cas para reducir la expansión de CGG a una longitud que no cause FXS.
“Cuando dividimos el CGG en una longitud más corta llamada mutagénesis (100-190 tripletes), observamos que muchas áreas grandes de silenciamiento de heterocromatina se revirtieron y múltiples cromosomas se segregaron espacialmente de FMR1”, dijo el coautor Ken Chandrados. y Ravi Pooya, Ph.D., son investigadores postdoctorales en el laboratorio Phillips Crimmins.
Los experimentos del equipo demostraron que los genes originalmente silenciados por BREACH se reexpresaban en células FXS con repeticiones CGG acortadas por CRISPR.
“La amplia implicación de nuestro descubrimiento de que la expansión de CGG a lo largo de la mutación es esencial para el mantenimiento de BREACHes es que la ingeniería repetitiva por sí sola podría usarse como un enfoque terapéutico para revertir el silenciamiento de todo el genoma de múltiples genes críticos que potencialmente contribuyen a las presentaciones clínicas de FXS”, dijo el coautor principal Thomas Malachowski, estudiante en el laboratorio de Crimmins.
Los tratamientos futuros del FXS pueden explorar la sustitución de las funciones de algunos, pero no solo, de los genes silenciosos identificados en el estudio. Boletín de Migración Forzada1. Sin embargo, los investigadores señalan que una estrategia más ambiciosa sería limitar la expansión de la repetición CGG muy larga en un momento específico durante el desarrollo para prevenir o al menos revertir los efectos del silenciamiento de la heterocromatina. Para explorar esta posibilidad será necesario equilibrar cuidadosamente los efectos positivos de la reactivación de genes importantes con el papel protector que desempeña la heterocromatina en la prevención de la inestabilidad genómica recurrente.
Ejemplos de otros trastornos potencialmente afectados por estos hallazgos incluyen la enfermedad de Huntington y la esclerosis lateral amiotrófica (enfermedad de Lou Gehrig), que son miembros de la misma clase más amplia de trastornos de expansión repetida que el FXS, que se cree que están impulsados por una mutación en un solo gen. . El tracto repetitivo en el ADN.
Phillips-Cremins también explicó que el equipo ha observado brechas en otros modelos celulares humanos de inestabilidad del genoma, incluidas líneas celulares que contienen mutaciones encontradas en el cáncer o roturas del ADN inducidas en laboratorio.
“Nuestros resultados sugieren que futuras violaciones pueden tener un impacto más amplio en el silenciamiento de genes en otras enfermedades con inestabilidad genómica, incluidos algunos cánceres y otros trastornos de expansión repetida”, dijo.
La investigación fue financiada por los Institutos Nacionales de Salud (1R01MH120269, 1DP1MH129957, 1U01DK127405, 1U01DA052715, F300HD098015, FUNDATS129317), la base de la Ciencias Nacionales (CBE-1943945), The New York, y la base de los Capas de los NewberBer. Ive (20) . 20-221479-5022; DAF2022-250430), Beca de la Familia Blavatnik, Beca Postdoctoral Druckenmiller de NYSCF y el Dr. y la Sra. Paul Bianco.
Penn Medicine es uno de los centros médicos académicos líderes en el mundo, dedicado a misiones relacionadas con la educación médica, la investigación biomédica, la excelencia en la atención al paciente y el servicio comunitario. La organización está formada por Sistema de salud de la Universidad de Pensilvania y un centavo Escuela de Medicina Raymond y Ruth PerelmanFue fundada en 1765 como la primera facultad de medicina del país.
La Facultad de Medicina Perelman se encuentra constantemente entre los mayores receptores de financiación de los NIH del país, con una concesión de 550 millones de dólares en el año fiscal 2022. Hogar de una orgullosa historia de “primeros” en medicina, los equipos de Penn Medicine han sido pioneros en descubrimientos e innovaciones que dan forma a la medicina Talk, incluyendo descubrimientos recientes como la terapia con células T CAR para el cáncer y la tecnología de ARNm utilizada en las vacunas COVID-19.
Las instalaciones de atención al paciente del Sistema de Salud de la Universidad de Pensilvania se extienden desde el río Susquehanna en Pensilvania hasta la costa de Nueva Jersey. Estos hospitales incluyen la Universidad de Pensilvania, Penn Presbyterian Medical Center, Chester County Hospital, Lancaster Public Health, Penn Medicine Princeton Health y Penn Hospital, el primer hospital del país, fundado en 1751. Instalaciones e instituciones adicionales incluyen Good Shepherd Penn Partners, Penn Medicine's home, Lancaster Behavioral Health Hospital y Princeton House Behavioral Health, entre otros.
Penn Medicine es una institución de 11.100 millones de dólares administrada por más de 49.000 profesores y personal talentosos.

“Defensor de la Web. Geek de la comida galardonado. Incapaz de escribir con guantes de boxeo puestos. Apasionado jugador”.
